26 Mayıs 2021 itibarıyla Avrupa Birliği, Tıbbi Cihazlar (MDR) konusunda daha katı kurallar uygulamaktadır. 26 Mayıs 2022’den itibaren yeni düzenlemeler In Vitro Diagnostic (IVDR) Yönetmelikleri için de geçerli olacak.
Distribütörler ve ithalatçılar gibi tarafların, kendilerinin ve cihazın uyumlu olması için yerine getirmeleri gereken belirli yükümlülükleri vardır.
Bu yeni regülasyonun Distribütör veya ithalatçı olarak getirdiği yükümlülükler ölçüsünde Sisteminizi Kuralım.
MDR ve IVDR Article 13 ve Article 16 Kapsamında sürecinizi yönetmenize yardımcı olalım.
MDR / IVDR İthalatçılar için gereksinimler
Avrupa Birliği dışından Avrupa pazarına cihaz mı ithal ediyorsunuz? O zaman yeni MDR düzenlemeleri sizin için de geçerlidir. EUDAMED’e zamanında kayıt yaptırmanızı sağlayalım.
Bazı durumlarda üretici, distribütör ve ithalatçının hepsinin aynı şirket olabileceğini belirtmek önemlidir. Bu durumda, şirketin her üç tarafın da yükümlülüklerini yerine getirmesi gerekecektir. Ancak, bu her zaman böyle değildir ve bazen bir şirket rollerden yalnızca birini veya ikisini oynayabilir. Düzenlemelerdeki rolleri anlamak zor olabilir, yakın zamanda değiştirilen düzenlemelerdeki rolleri anlamak ve sürecinizi risksiz yönetmek için MedENvolve Consultancy bu yükümlülüklerin yerine getirilmesinde sizin çözüm ortağınız olacaktır.
MedENvolve Consultancy MDR ve IVDR Distribütor ve İthalatçı firmalar için Yeni MDR ve IVDR süreçlerinde Sistem Kurulum ve EUDAMED kayıt süreçlerinde Danışmanlık hizmetleri sunar. 05447782036 numaralı telefondan bizi arayın, info@medenvolve.com adresinden bize e-posta gönderin, bugün uzman ekibimizle iletişime geçin.
MDR/ IVDR : Distribütör için Gereksinimler
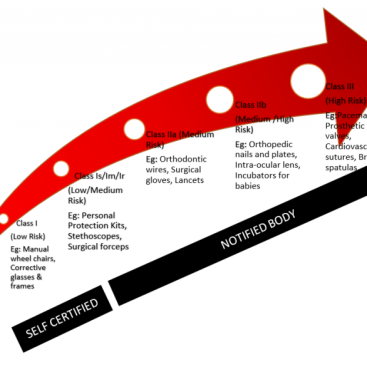
Tıbbi cihazlara yönelik yeni Avrupa Birliği yönetmeliği, EU MDR 2017/745, daha yeni yürürlüğe girdi ve ilgili taraflar halen eski MDD 93/42/EEC yönetmeliğinden geçiş için çalışıyor. Düzenlemenin nasıl uygulandığı hakkında daha fazla bilgi edinmek için sitemize göz atabilirsiniz. Düzenlemenin önemli bir yönü, bir ürünün tedarik zincirindeki üreticiler, distribütörler, ithalatçılar ve yetkili temsilciler dahil ilgili taraflar arasında yaptığı ayrımdır. Şimdi MDR’nin çoğu üreticiler için geçerli olsa da, yönetmeliğin belirli bölümleri her bir tarafın üstleneceği belirli sorumlulukları detaylandırıyor.
AB MDR 2017/745’e ve IVDR 2017 / 746 ‘ya geçiş, birçok şirket için büyük bir zorluktur.
Oynanan rolü anlamak, başarılı bir geçişin anahtarıdır.
MedENvolve Consultancy, yeni yönetmeliği anlamanıza, şirketinizin ve cihazınızın regülasyona uyumlu proseslerden geçtiğine emin olmanıza ve cihazınızı EUDAMED‘e kaydetmenize yardımcı olur.