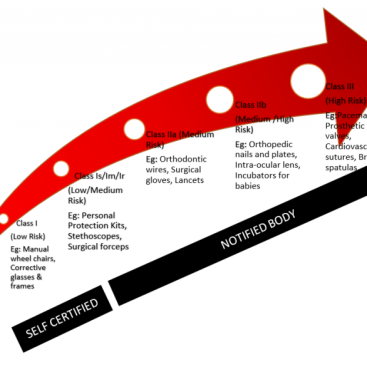
Tıbbi cihaz direktifi 93/42/EEC ve tıbbi cihaz yönetmeliği 2017/745 ve hatta bir dereceye kadar 2017/746 (in vitro tanı cihazları için) kapsamında tıbbi cihazlar için klinik değerlendirme gereklidir . CE işareti bağlamında klinik değerlendirme için de pek çok kılavuz vardır: MEDDEV 2.7.1 en önemlisidir.
Klinik değerlendirme, klinik güvenliğini ve performansını doğrulamak için bir tıbbi cihaza ilişkin klinik verilerin değerlendirilmesi ve analizidir. Değerlendirme, kullanım amacı ile ilgili, piyasaya arz öncesi ve sonrası klinik verilerin kapsamlı analizine dayanmaktadır. Bu, cihaza özel verilerin yanı sıra üretici tarafından eşdeğer olduğu iddia edilen cihazlarla ilgili tüm verileri içerir. Tüm süreç bir klinik değerlendirme raporunda (CER) belgelenmiştir.
Bu amaçla aşağıdaki veri örneği hazırlanabilir:
- Klinik Araştırmalar
- Literatür arama ve inceleme
- Güvenlik ve performansı göstermek için eşdeğer ürün verileri (literatür ve advers olaylar)
- Klinik deneyim (implant kayıtları vb…)
- Pazar sonrası veriler
Aşağıdaki yönleri ayırt etmeliyiz:
- Tekniğin son durumu: mevcut bilgi ve mevcut ürünler ışığında cihazın veya teknolojinin nasıl konumlandırılacağı. Bu genellikle, son zaman penceresiyle kullanım göstergesi için bir literatür araştırması yapılarak yapılır.
- Güvenlik ve performans iddiaları: iddiaların iyi desteklendiğini göstermek için, ürünün kendisi ve eşdeğer ürün için mevcut tüm literatürü belirlemek önemlidir.
Klinik Değerlendirme Raporu (CER), tıbbi cihazınızın klinik değerlendirmesinin sonuçlarını belgeler. Bir CER, cihazınızla ilgili klinik bir araştırmadan veya büyük ölçüde eşdeğer cihazlar üzerinde yapılan diğer çalışmaların sonuçlarından toplanan analiz edilmiş klinik verilerden oluşur. CER, cihazınızın amaçlanan amacına, kullanıcıları ve hastaları daha fazla riske maruz bırakmadan ulaştığını gösterir.
Avrupa’daki tüm tıbbi cihazlar için Klinik Değerlendirme Raporları gereklidir. CER’inizi Onaylanmış Kuruluşunuza Avrupa CE Teknik Dosyanızın eki olarak sunmalısınız. Teknik Dosya, Avrupa’da tıbbi cihaz satmak veya dağıtmak için gerekli olan, cihazınız için CE İşareti almak için önemli bir adımdır.
Tıbbi cihazlar için Klinik Değerlendirme Raporu nasıl hazırlanır
Klinik değerlendirme üç adımda gerçekleşir. Birinci adımda, üreticiler mevcut literatürden, klinik deneyimden, klinik deneylerden veya üçünün herhangi bir kombinasyonundan elde edilen klinik verileri tanımlar. İkinci aşama, verilerin alaka düzeyini, uygulanabilirliğini, kalitesini ve önemini değerlendirmeyi içerir. Üçüncü adım, topladığınız verilere dayanarak CER’deki sonuçlarınızı ifade etmenizi gerektirir.
Teknik dosyanıza veya tasarım dosyanıza dahil edecek olsanız bile, CER’ye bağımsız bir belge olarak yaklaşın. CER’nize dahil edilecek olası öğelerin bir listesi aşağıdaki gibidir:
- Genel bilgi: cihaz ve üretici adı
- Kısa fiziksel ve teknik cihaz açıklaması ve amaçlanan uygulama
- Amaçlanan terapötik veya tanısal iddiaların ana hatları
- Son teknoloji tartışması
- Klinik değerlendirme ve veri türleri
- Klinik verilerin özeti ve gözden geçirme
- Ürün literatürünün performansını, güvenliğini ve alaka düzeyini/doğruluğunu değerlendirmek için kullanılan analizleri tanımlayın
- Güvenlik, performans ve uygunluk hakkında sonuçlar
Bu aynı zamanda bir literatür araştırma protokolü ve raporu ile pazar sonrası verilerle de desteklenir.
Klinik Değerlendirme Raporunuz için gerekli güncellemeler
Piyasaya arz sonrası gözetim ve teyakkuz faaliyetlerinizin bir parçası olarak CER’nizde düzenli güncellemeler gereklidir. İlk verileri etkileyen tüm önemli değişiklikleri kaydetmeli ve buna göre CER’yi eklemelisiniz. Bunun yapılmaması, Tıbbi Cihazlar Direktifine uygunluğunuzu tehlikeye atabilir.
Avrupa’nın yeni Tıbbi Cihaz Yönetmeliği (MDR), başka bir cihazla eşdeğerlik oluşturmanın temeli ve klinik değerlendirmenizde dikkate alınan verilerin kalitesi gibi Klinik Değerlendirme Raporları için daha da katı gereklilikler getirecektir.
Hizmetlerimiz
Hizmetlerimiz şunları içerir:
- Konsültasyon : klinik değerlendirme planı için geliştirilecek en iyi strateji
- Son teknolojinin gözden geçirilmesi
- Pazar sonrası veri hazırlama
- Literatür tarama protokolünün hazırlanması
- Literatür araştırma raporunun hazırlanması
- Performans ve güvenlik analizi ve kritik değerlendirme
- Risk değerlendirmesiyle bağlantı
- Klinik Değerlendirme Raporunun hazırlanması: yukarıdakilerin tümünün genel özeti