Bir tıbbi cihazdan, amaçlandığı gibi kullanıldığında ve hastanın vücuduyla temas ettiğinde hastada herhangi bir biyolojik tepki uyandırmaması beklenmektedir. Biyolojik tepki, cihazın vücutla olan temas profiline (temas eden dokuya/vücut sıvısına ve temas süresine) bağlı olarak;
- hücre bazında (sitotoksik) olabildiği gibi
- lokal (örn. iritasyon/sensitizasyon),
- sistemik (örn. akut, subakut/subkronik ya da kronik toksisite) ya da
- mutajenik (örn. genotoksisite/kanserojenlik) ölçekte gerçekleşebilir.
Tıbbi Cihazların bu tür etkilere sahip olmadığını doğrulamak amacıyla cihazlar biyouyumluluk değerlendirme sürecine tabii tutulmaktadır. Biyouyumluluk değerlendirme süreci, ISO 10993 standart serisinde detaylıca anlatıldığı gibi tıbbi cihaz üzerinde yapılmış biyolojik/kimyasal analiz testlerini, bilimsel literatürler ve hayvan testlerini de içeren çok boyutlu bir süreçtir. Tıbbi Cihazın biyouyumluluk verileri ISO 14971 standardı uyarınca risk analizinde işlenir ve mevcut Tıbbi Cihaz Yönetmeliği/Regülasyonu’nca belirlenen ilgili Temel Gereklilikler’i karşıladığına dair kanıt olarak sunulur.
Biyolojik Değerlendirme
Biyolojik Değerlendirme, risk yönetimi sürecinde tıbbi cihazın biyolojik güvenliğini değerlendirmek için, uluslararası standartlar yardımıyla, klinik öncesi gerek in-vitro, gerekse in-vivo tekniklerle hayvan modelleri üzerinden yapılabilen bir dizi testtir.
Biyolojik Değerlendirme, bir materyalin biyolojik bir sistemle uyumluluğunu ölçmek için yapılır. Değerlendirme, örneğin farmasötikler, kozmetikler ve tıbbi cihazlar gibi ürün tipine karşılık gelen bir standarda göre bir dizi test kullanılarak, malzeme veya cihazın kullanımı sırasında insanlar için herhangi bir potansiyel riske neden olmayacağını göstermek için gerçekleştirilir.
Biyolojik değerlendirmenin birincil amacı, hastayı tıbbi cihazın oluşturduğu biyolojik riskten korumaktır.
Biyolojik Değerlendirme Raporu
Biyolojik Değerlendirme Raporu, yapılan tüm biyolojik testlerin ve yapılmayan testlerin gerekçelerinin toplu bir özetidir. Buna literatürden destekleyici veriler, verilerin değerlendirilmesi, biyolojik güvenlik için halihazırda mevcut bilgiler için boşluk analizi, ek bilgilerin neden gerekli olmadığına ilişkin gerekçe ve tamamlanmış biyolojik risk analizi ve risk kontrollerini doğrulayan bir ifade dahildir.
Rapor, bir tıbbi cihazın kullanımı sırasında hastalar ve hedef kullanıcılar için herhangi bir potansiyel risk oluşturmayacağını göstermek için kullanılır.
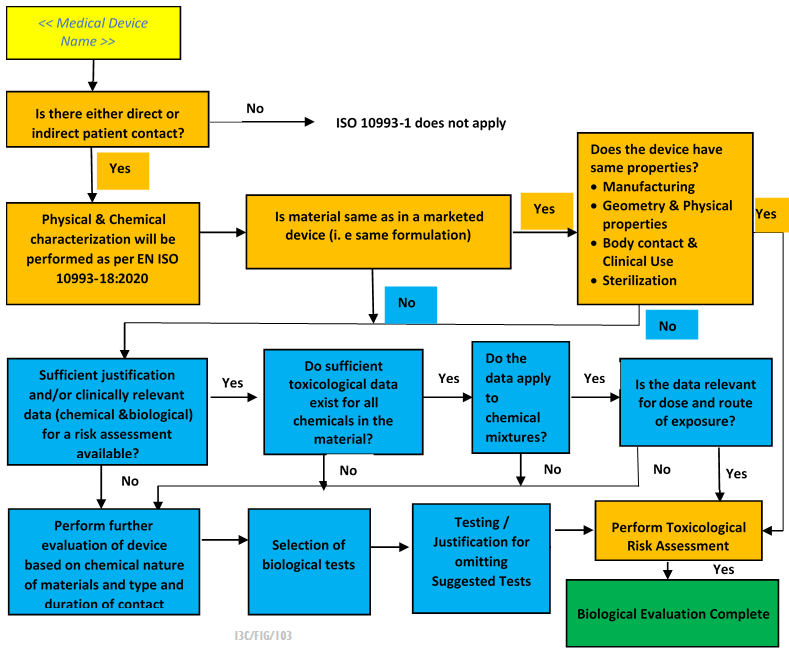
Biyolojik Değerlendirme Planı
İlgili standartlara uygunluğu göstererek ve cihazın gereksiz test edilmesini önleyerek cihazın güvenliğini kanıtlamak için bir Biyolojik Değerlendirme Planı kullanılır.
Biyolojik değerlendirme bir risk yönetimi faaliyeti olduğundan, bir Biyolojik Değerlendirme Planı gereklidir ve bu, Risk Yönetim Planının bir parçasını oluşturur.
Biyolojik değerlendirme planı sadece biyouyumluluk testlerini değil, aynı zamanda ISO 14971 risk yönetiminin gerekliliklerini de vurgulamaktadır. Biyolojik değerlendirme planı, bilgili ve deneyimli bir ekip tarafından hazırlanmalı ve şunları içermektedir:
- Yayınlanmış literatürden uygulanabilir bilgilerin toplanması için düzenlemeler
- Genel tasarım kontrol sürecinin bir parçası olarak planın gözden geçirilmesi ve onaylanması için düzenlemeler
- Değerlendirmenin nihai sonuçlarının gözden geçirilmesi için düzenlemeler ve gerekli herhangi bir ek testin onayı
- Biyolojik risk değerlendirmesinin sonuçlarının nihai gözden geçirilmesi ve onaylanması için düzenlemeler
Biyolojik Değerlendirme sırasında dikkate alınan faktörler
- Yapı malzemesi/malzemeleri (yani, tüm doğrudan ve dolaylı doku temas malzemeleri);
- Tıbbi cihaz konfigürasyonu (örn. boyut, geometri, yüzey özellikleri)
- Cihazın üretimi sırasında amaçlanan katkı maddeleri, proses kirleticileri ve kalıntılar
- Üretim süreçleri
- Tıbbi cihazla doğrudan veya dolaylı olarak temas eden ambalaj malzemeleri
- Sızan maddeler ve Bozunma ürünleri
- Diğer bileşenler ve nihai üründeki etkileşimleri
- Nihai ürünün performansı ve özellikleri
- Cihazın fiziksel ve kimyasal özellikleri
- İmplante edilebilir cihazların sistemik etkileri ve lokal etkileri
- Her malzemenin ve nihai ürünün biyolojik tehlikeleri
- Mevcut toksikoloji ve diğer biyolojik güvenlik verileri