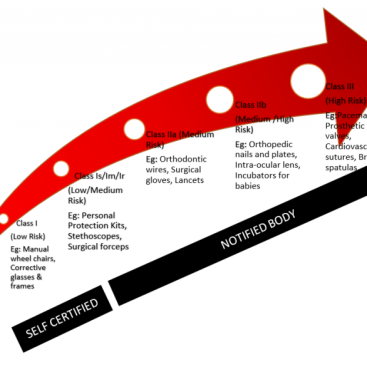
ISO 14971’in arka planını gözden geçirelim. Bir tıbbi cihaz üreticisi olarak yapmanız gereken ilk şey, cihazlarınızın yapması gerekeni yaptığından emin olmaktır. Ardından, kullanılmasını düşündüğünüz pazarlar için belirlenmiş düzenlemeleri ve standartları karşıladığından emin olmanız gerekir.
Risk yönetimi, piyasada tıbbi cihazların imalatının ve nihai satışının ve kabulünün ayrılmaz bir parçasıdır. Üreticiler, tıbbi cihaz üretirken, son kullanıcının cihaz konusunda bir seçeneği olmayabileceğini her zaman göz önünde bulundurmalıdır.
Bu nedenle, bir üretici olarak, cihazlarınızın düzenleyiciler ve müşterileri üzerinde kullanan doktorlar tarafından kabul edilmesi için ortaya konan tüm risk yönetimi standartlarını karşılamanız gerekir.
Risk Yönetimi Nedir?
Risk yönetimi, bir tıbbi cihaz üreticisinin tehlikeleri ve riskleri tanımlayıp analiz edebildiği ve riskleri kontrol etmek ve izlemek için politikalar geliştirebildiği süreçtir. Risk, zararın meydana gelme olasılığı ve meydana gelmesi halinde zararın boyutudur.
ISO 14971;
- ISO 14971, tıbbi cihaz imalatında risk yönetimi için talimatlar ve yönergeler sağlayan geçerli Uluslararası Standarttır.
- Standart, tıbbi cihaz üreticilerine uygun bir risk yönetimi süreci oluşturma ve izleme konusunda rehberlik etmek için kullanılmalıdır.
- Düzenleyiciler, tıbbi cihazları değerlendirirken ve piyasaya girmesine izin verirken bu standart tarafından sağlanan yönergeleri takip eder.
- ISO 14971, bir tıbbi cihazın yaşam döngüsü boyunca risklerin tanımlanması ve izlenmesi için standart bir süreç sağlamak için geliştirilmiştir. Bu standart, bu risklerin ürün tasarımı ve konsept aşamasından, satın alma, üretim ve pazar sonrası kullanımdan itibaren izlenmesini sağlar.
- Tıbbi cihazlar, çeşitli paydaşlardan ilgi görmektedir. Bunlara üreticiler, doktorlar, hükümetler, diğer sağlık çalışanları ve hastalar dahildir. Bu nedenle, tıbbi cihazlar için risk yönetimi süreçlerine ilişkin standart bir çerçeve, tüm bu paydaşların cihazların risk yönetimi süreci üzerinde anlaşmaya varması açısından önemlidir.
- Standartta sağlanan yönergelere ek olarak belgenin ekleri de bulunmaktadır. Eklerde, kılavuzların ayrıntılı açıklamaları ve sağlanan risk yönetimi prosedürlerinin nasıl uygulanacağına ilişkin ayrıntılı örnekler yer almaktadır.
- Bu standart zamanla gelişti ve tıbbi cihaz üreticileri için risk yönetimi konusunda kapsamlı bir kılavuz haline geldi. En son teknolojiye sahip güncel kılavuz yakın zamanda 2019’da yeniden yayınlandı. Önceki standartlar artık mevcut standarda yönelik kılavuzlar olarak kullanılmaktadır.
- ISO 14971, tıbbi cihaz risk yönetimi ile ilgili terimlerin tanımlarını içerir. Ayrıca, bir risk yönetim sistemi için bazı genel gereksinimleri verir, ardından risk analizi, değerlendirmesi ve kontrolü hakkında kılavuzlar sağlamaya devam eder. Ayrıca, tıbbi cihazlar için bir risk yönetimi gözden geçirme kılavuzu ve üretim ve üretim sonrası faaliyetler sağlar.
ISO 14971’de tanımlanan bazı terimler şunları içerir:
- Tehlike-olası bir zarar kaynağı.
- Zarar – bir kişinin fiziksel olarak yaralanması veya mülke veya çevreye verilen zarar.
- Risk analizi – mevcut bilgilerle tehlikeleri belirleme ve zararın ciddiyetini hesaplama süreci.
- Risk tahmini – zararın meydana gelme olasılığını hesaplama ve ciddiyetini tahmin etme süreci.
- Risk değerlendirmesi – risk ciddiyetini risk kriterlerine bağlama
- Risk kontrolü – riski ortadan kaldırmak, azaltmak veya belirli bir düzeyde sürdürmek için önlemler geliştirme süreci.
- Artık risk- gerekli risk kontrol önlemlerini aldıktan sonra bile oluşabilecek risk.
Risk Yönetim Süreci
ISO 14971 standardını okuyup anladığınızda, şimdi risk yönetimi sürecinizi oluşturmanız size kalmış. Bir tıbbi cihaz üreticisi için risk yönetimi sürecinin geliştirilmesine başlamak için organizasyonun üst yönetimi dahil edilir.
ISO 14971, üst yönetimin sorumlu olmasını ve kapsamlı risk yönetimi için kaynak sağlamasını önerir. Üst yönetimin de ürettikleri cihazlar için kabul edilebilir risk seviyelerini belirleyen bir risk yönetimi politikası oluşturması gerekmektedir.
ISO 14971 tarafından sağlanan risk yönetimi süreci aşağıdaki adımları içerir.
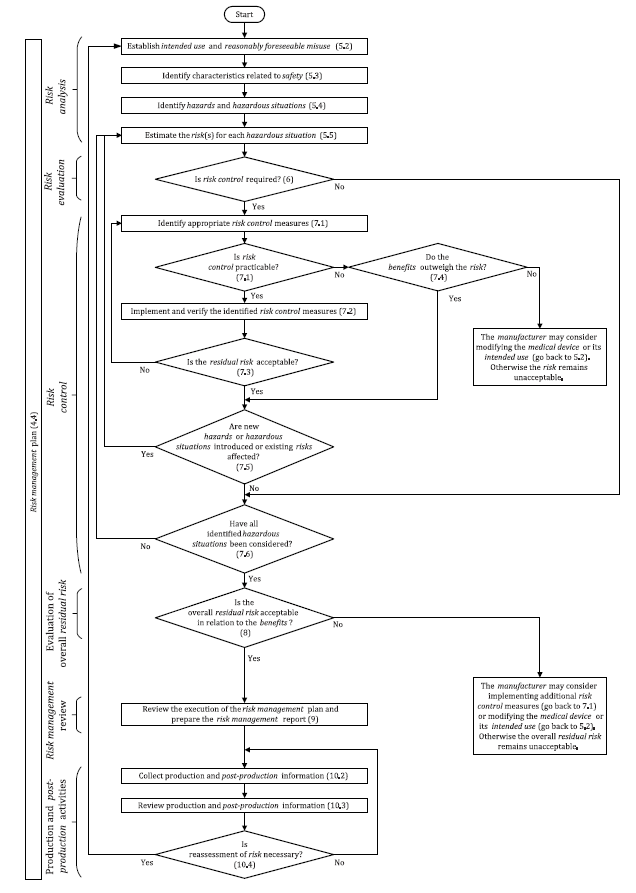
Adım 1. Kuruluşta bir risk yönetimi çerçevesinin oluşturulması
Kuruluşun üst yönetimi, ürettikleri tüm tıbbi cihazlar için kuruluşun risk yönetim planının yazılı bir politikasını oluşturmak zorundadır. Bu, organizasyondaki farklı tarafların rollerini ve sorumluluklarını içeren net bir risk yönetim süreci oluşturmaya yardımcı olacaktır.
Adım 2. Üretilmekte olan cihazın kullanım amacını tanımlayın ve sağlayın
Risk yönetimi politikası, risk yönetimi sürecinin gerçekleştirildiği cihazı tanımlamalıdır. Ayrıca, piyasaya arz edildiğinde cihazın kullanım amacını da belirtmelidir. Bu, cihazın kullanım ömrü boyunca ilişkili olabilecek risklerin kolayca değerlendirilmesine yardımcı olur.
Adım 3. Tehlikeleri Tanımlayın
Tasarım/üretim ekibi ile birlikte üst yönetim, risk yönetimi sürecini geliştirmenin bu aşamasında tasarladıkları/ürettikleri cihaz için potansiyel risk kaynaklarını belirlemelidir.
Adım 4. Öngörülebilir herhangi bir kötüye kullanımı tanımlayın
Bu, potansiyel riskleri belirlemeye ve bunlardan nasıl kaçınılacağını önceden planlamaya yardımcı olur.
Adım 5. Risk tahmini
Herhangi bir zamanda meydana geldiyse potansiyel riskin ciddiyetini değerlendirin.
Adım 6. Risk değerlendirmesi
- Belirlenen potansiyel risklerle, bunların meydana gelme olasılığı ne kadardır?
- Risklerin meydana gelme olasılığının sıklığını azaltmak mümkün müdür?
Bu aşamada bu iki soruyu yanıtlayın.
Adım 7. Risk Kontrolü
Kuruluşun, risklerin ne zaman oluştuğuna ilişkin risk kontrolleri hazırlaması gerekir. Risk kontrolü, ortaya çıkması durumunda riskin ciddiyetini sınırlayabilecek adımları veya koşulları içerir.
Adım 8. Risk Kabul Edilebilirliğini Değerlendirin
- Üretmekte olduğunuz tıbbi cihazın amacı dikkate alındığında, tanımlanan riskler kabul edilebilir mi?
- Varsa, riskin oluşma olasılığını ve ciddiyetini en aza indirmenin yolları var mı?
Bu soruların cevapları, kullanımının etkisi olumluysa, cihazı üretmeye devam etmenizi sağlayacaktır.
Risk kabul edilebilirlik seviyesini değerlendirdiyseniz ve kabul edilemez bulduysanız, tıbbi cihazın üretimini durdurabilirsiniz.
Adım 9. Risk Yönetim Sürecinizi Gözden Geçirin
Risk yönetimine ilişkin kurumsal politikayı takip ettiğinizi kontrol ederek risk yönetimi sürecini gözden geçirin. Ayrıca, doğru süreci izlediğinizden emin olmak için ISO kılavuzuna başvurmak en iyisidir. Ardından incelemeniz hakkında bir rapor hazırlayın.
Artık cihazınızın üretimine başlayabilirsiniz.
Adım 10. Üretim ve Üretim Sonrası Faaliyetler
Cihazın üretiminden kaynaklanan her türlü yeni bilgiyi kaydedin ve raporlayın. Testler yapacaksanız, alabileceğiniz tüm yeni bilgileri kaydedin. Ürünün nasıl çalıştığına ve önceden tanımlanamayan risklere ilişkin olasılığa ilişkin müşteri geri bildirimlerini kaydedin.
Risk yönetimi ve gözden geçirme sürekli bir süreçtir. Bu nedenle, üretilen cihazla ilgili yeni gelişmeleri takip etmeli ve uygulamalısınız.
Risk Yönetim Planı Yapın
Üst yönetim düzeyinde, kuruluş, risk yönetimi süreci etrafında politika geliştirecektir. İdeal olarak, bu, ürününüz üretime geçmeden önce gerçekleşmelidir. Ayrıca, üretim sonrası yeni bilgiler ortaya çıktıkça gözden geçirilmelidir.
Ürününüz piyasaya çıktığında bir risk yönetim planı yapmanız gerekir. Bu, ürün piyasadayken ortaya çıkan risklerle nasıl başa çıkılacağına ilişkin bir plandır.
Normalde sadece bir ürün üretiyorsanız, risk yönetim süreci bir risk yönetim planı için yeterlidir. Birden fazla ürününüz varsa, her ürün için bir risk yönetim planına ihtiyacınız vardır.
Risk yönetimi sürecinizi bir rehber olarak kullanarak, ürününüzü etkileyebilecek tanımlanmış tüm riskleri listeleyin. Ardından, ortaya çıkması durumunda riski kontrol altına almak veya en aza indirmek için atacağınız tüm eylem adımlarını listeleyin.
Gerçekleşecek tüm faaliyetleri kaydedin ve farklı risk yönetimi faaliyetlerinden sorumlu olacak kişileri belirleyin. Pazara sunduğunuz her tıbbi cihaz için bir risk yönetim ekibiniz olsun. Ürünün üretimi ve amacı konusunda bilgili olmalıdırlar.
Risk yönetimi planında, risk yönetimine yardımcı olacak yeni bilgileri nasıl elde edeceğinizi belirleyin.
Belirlenen bir riskin meydana gelme veya oluşmama olasılığına ilişkin herhangi bir yeni bilgiye sahip olduğunuzda, risk yönetim planını gözden geçirmeye devam edin.
Riski Araştırın
Ürüne özel bir risk yönetim planınız olduğunda, bir sonraki adım riski araştırmaktır. Ürünün kullanım amacını ve öngörülebilir yanlış kullanımını göz önünde bulundurun. Bu parametreleri kullanarak, ürününüz için potansiyel risklere neden olabilecek tehlikeleri kolayca belirleyebilirsiniz. Bir risk analizi aracı bunu yapmanıza yardımcı olacaktır.
İlk adım, ürün ve hizmetinizin değer zinciri çevresinde doğabilecek riskleri araştırmaktır. Diğer risk türlerinin yanı sıra, tedarikçileriniz gibi taraflardan kaynaklanan riskleri, ürünü yol tarifi pazarına gönderirken ortaya çıkabilecek riskleri belirleyin.
Risk analizi için kullanabileceğiniz birçok araç bulunmaktadır.
Ürününüzün ortaya çıkacağı riskleri belirledikten sonra, şimdi riskinizi kontrol etmenin yollarını bulmanız gerekiyor. Bu durumda, riskleri kolayca yönetebilmek için ürünün kullanımına ilişkin kurallar koyabilirsiniz.
Kullanıcıların ürünü amacına uygun şekilde kullanabilmesi için kullanıcı eğitimlerinin gerçekleştirilmesi. Nasıl kullanılacağını göstermek için cihaza yapıştırılmış uyarı etiketlerini de kullanabilirsiniz. Doktorlar ve diğer kullanıcılar, cihazın doğru şekilde kullanıldığından emin olmak için bu uyarıları takip edebilir.
Ayrıca bir risk-fayda analizi yapın. Bu, oluşturduğunuz tıbbi cihazın kullanımından elde edilecek risklerin faydalarından daha büyük olup olmadığını belirlemenize yardımcı olacaktır. Bunu, oluşturduğunuz cihazın yaşam döngüsü boyunca yapacaksınız.
Risk Kontrolleri
Risk kontrolleri, tanımlanan risklerin etkisini ve oluşma olasılığını azaltmak için cihazınızla birlikte aldığınız önlemlerdir.
Risk kontrolleri, risk yönetimi sürecinin bir parçasıdır. Risklerin nasıl ele alınacağına dair bir politika geliştirirken, riskin oluşma olasılığını düşürmeyi düşünmeniz gerekir.
Risk kontrolleri, ürettiğiniz tıbbi cihazın yaşam döngüsünün farklı seviyelerinde değerlendirilebilir. İlk aşama, tıbbi cihazın tasarımı ve üretimidir. Bu noktada, üretim kuruluşları, risklerin oluşumunu azaltabilecek doğal güvenlik özellikleri eklemeye çalışmalıdır.
Bu, cihazın piyasada denendiği zaman zaten güvenli olacak şekilde tasarlanması gerektiği anlamına gelir.
Göz önünde bulundurulması gereken diğer bir risk kontrolü seviyesi, cihaz içinde koruyucu önlemlerin bulunmasını sağlamaktır. Belirlenen risklerden biri elektriksel sorunlarsa, üreticiler ürünün gücün kullanımını sınırlayan bir sigorta ekleyebilir. Bu, cihazdan kaynaklanan bir elektrik arızası veya cihaza zarar verme riskini azaltacaktır.
Üçüncü seviye risk kontrolleri, cihaz üzerinde kullanım için uyarılar ve talimatlar sağlamaktır. Bu seviye, cihazın üretilme amacını dikkate alır. Ayrıca kötüye kullanım olasılığını da göz önünde bulundurur.
Böylece üretici, cihazda kullanım talimatları sağlayabilir. Yeterince büyük bir cihazsa, talimatlar cihaza yapıştırılabilir. Küçük bir cihaz için talimatlar ambalajın üzerine yazılabilir.
Ayrıca üreticiler, tıbbi cihazların ana kullanıcılarına, cihazları gerektiği gibi kullanmalarını sağlamak için eğitimler düzenleyebilir. Ayrıca, kullanıcı için risklerin de kontrol edildiğinden emin olmaya yardımcı olur.
Risk Yönetimi Sonuçlarınızdan Rapor Oluşturun
Cihazınızın risk yönetimi süreciyle ilgili ISO 14971 yönergelerini kapsamlı bir şekilde izlediğinizde, yaptığınız her şeyi belgelemeniz gerekecektir.
Bunu, cihazınız veya cihazlarınız için bir risk yönetimi raporu oluşturarak yapacaksınız. Bu raporda, tıbbi cihaz risk yönetimi için tüm ISO standartlarına uyduğunuzu onaylayacaksınız. Ayrıca, risk yönetimi azaltmanızın sonuçlarını ve ürettiğiniz tıbbi cihazdaki yapısal riski nasıl azalttığınızı belgeleyeceksiniz.
Son olarak, ISO 14971 diğer standartlarla güçlü bir bağlantıya sahiptir. Öncelikle ISO 13485 , çünkü bu standardın risk yönetimine çok sayıda referansı vardır ve bu nedenle ISO 14971 yöntemleri uygulanmalıdır. Diğer standartların da ISO 14971 ile güçlü bağlantıları vardır. Birkaçını saymak gerekirse: ISO 10993-1 (tıbbi cihazların biyolojik değerlendirmesi), IEC 62344 (tıbbi cihaz yazılımı) veya IEC 62366-1 (kullanılabilirlik).