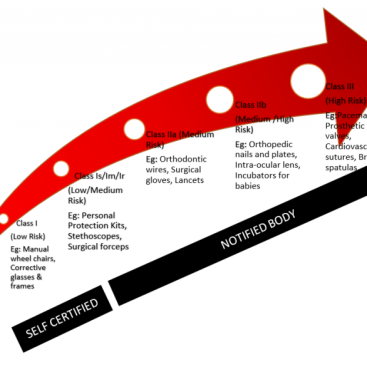
MDSAP (Tıbbi Cihaz Tek Denetim Programı), farklı düzenleme sistemleri arasında (çok) az sayıdaki uyumlaştırma programından biridir.
MDSAP, bir Tıbbi Cihaz Tek Denetim Programı oluşturmak için özel belgeler geliştirmek üzere bir çalışma grubu belirleyen Uluslararası Tıbbi Cihaz Düzenleyicileri Forumu (IMDRF) tarafından geliştirilmiştir.
Ocak 2014’ten bu yana FDA, diğer uluslararası ortaklarla birlikte bir Pilot aşamaya katılıyor. Pilot aşama Aralık 2016’da sona erdi ve resmi program Ocak 2017’de başladı.
MDSAP programı, MDSAP tarafından tanınan Denetim Kuruluşlarının, programa katılan tıbbi cihaz düzenleyici makamlarının ilgili gereksinimlerini karşılayacak bir tıbbi cihaz üreticisinin tek bir denetimini gerçekleştirmesine izin vermeyi amaçlamaktadır.
MDSAP katılımcıları:
Programa katılan uluslararası ortaklar:
- Food and Drug Administration of United States of America
- Therapeutic Goods Administration of Australia
- Brazil’s Agência Nacional de Vigilância Sanitária
- Health Canada
- Japan’s Ministry of Health, Labour and Welfare, and the Japanese Pharmaceuticals and Medical Devices Agency
- The World Health Organization (WHO) Prequalification of In Vitro Diagnostics (IVDs) Programme and the European Union (EU) are Official Observers
Health Canada, 1 Ocak 2019 itibariyle mevcut CMDCAS programını sonlandırdı ve yalnızca MDSAP sertifikalarını kabul etti.
ISO 13485 versiyon 2016 yayınını takiben denetim modeli güncellendi ve artık standardın bu versiyonuna göre denetimler yapılabilmektedir.
MDSAP program bilgileri ve destekleyici belgeler bu FDA web sayfasında barındırılmaktadır. Örneğin prosedürler ve politikalar, denetim modeli, refakatçi, formlar ve ayrıca eğitim materyali içerir. Bununla birlikte, dokümantasyonun çoğunlukla (eğitim materyali dahil) denetim kuruluşları için tasarlandığına dikkat edilmelidir. Soru-Cevap belgesi de mevcuttur.
Katılımcı Düzenleyici Kurumlar tarafından MDSAP nasıl değerlendirilir?
Aşağıda tanımlandığı gibi, programda yer alan ülkelere cihaz ihraç etmek istiyorlarsa, dünya çapında ayak izine sahip işletmeler için MDSAP düşünülmelidir.
MDSAP pilot programına dahil edilen beş Düzenleyici Kurum, MDSAP raporlarından nasıl yararlanmayı düşündüklerine ilişkin aşağıdaki açıklamaları yapmaktadır
- Avustralya: Therapeutics Goods Administration TGA, tıbbi cihaz yetkilendirme gerekliliklerine uygunluk açısından değerlendirilen içerik olarak MDSAP denetim raporunu kullanır. Tıbbi cihazın başka bir şekilde gereksinimlerden muaf tutulması veya muaf tutulması ya da mevcut politikaların MDSAP denetim raporlarının kullanımını sınırlaması durumu hariç.
- Brezilya: Brezilya Ulusal Sağlık Gözetim Kurumu ANVISA, raporlar gibi programın çıktısını, ANVISA’nın pazar öncesi ve pazar sonrası değerlendirme sürecinde önemli bir girdi olarak kullanır. Uygulanabilir olduğunda, bu sorunlara ilişkin düzenleyici teknik değerlendirmeye yardımcı olması beklenen temel verileri sağlamak.
- Kanada: Health Canada HC, tıbbi cihaz üreticilerinin Kanada’ya cihaz yerleştirmeye devam etmek için CMDCAS’tan MDSAP’ye geçme zorunluluğunu yayınladı. 1 Ocak 2019’dan itibaren Health Canada (HC), yalnızca cihazlarını Kanada’da pazarlamak isteyen üreticiler için MDSAP sertifikalarını kabul eder. Bu nedenle üreticilerin onaylı bir denetim kuruluşu tarafından verilen MDSAP sertifikasına sahip olmaları gerekmektedir.
- Amerika Birleşik Devletleri: ABD Gıda ve İlaç İdaresi Cihazlar ve Radyolojik Sağlık Merkezi FDA, MDSAP denetim kayıtlarını FDA rutin denetimlerinin yerine kabul edecektir. FDA tarafından “Nedeni İçin” veya “Uyum Takibi” gerçekleştirilen denetimler programdan etkilenmez ve doğrudan FDA tarafından yürütülecektir. Ek olarak, MDSAP programı, Pazar Öncesi Yetkilendirme (PMA) uygulamaları için gerekli herhangi bir ön onay veya onay sonrası denetimler veya Kanun’un (21 USC 360c(f)(21 USC 360c(f)) bölüm 513(f)(5)) kapsamındaki kararlar için geçerli olmayacaktır. 5)) cihazın sınıflandırılması hakkında.
- Japonya: Sağlık, Çalışma ve Refah Bakanlığı (MHLW) ile Farmasötik ve Tıbbi Cihaz Kurumu (PMDA) bu denetim raporlarını Japonya’daki düzenlemeler kapsamında hem piyasa öncesi hem de periyodik piyasa sonrası denetimlerinde kullanacaktır.
MDSAP programının uygulanması için danışmanlık, değişiklikler için eğitim ve GAP analizi sunuyoruz.